| Главная » Статьи » 10 класс » Карбонильные соединения. Карбоновые кислоты |
| В категории материалов: 10 Показано материалов: 1-10 |
Сортировать по: Дате · Названию · Рейтингу · Комментариям · Просмотрам
Альдегиды и кетоны
АЛЬДЕГИДЫ И КЕТОНЫ – органические соединения, содержащие фрагмент >C=O (углерод, связанный двойной связью с кислородом, его называют карбонильным). У альдегидов карбонильный углерод соединен с атомом Н и органической группой R (общая формула RHC=O), а в кетонах – с двумя органическими группами (общая формула R2С=О).
Номенклатура альдегидов и кетонов. Группу –(Н)С=О называют альдегидной, для связывания с органическими группами у нее есть всего одна свободная валентность, это позволяет ей находится только на конце углеводородной цепи (но не в середине). При составлении названия альдегида указывается название соответствующего углеводорода, к которому добавляется суффикс «аль», например, метаналь Н2С=О, этаналь Н3СС(Н)=О, пропаналь Н3ССН2С(Н)=О. В более сложных случаях углеродную цепь группы R нумеруют, начиная с карбонильного углерода, затем с помощью числовых индексов указывают положение функциональных групп и различных заместителей.
Карбонильные соединения. Строение, изомерия, номенклатура
Вы уже знаете, что при окислении спиртов могут быть получены альдегиды или кетоны. Свойства карбонильных соединений очень сильно зависят от того, какие атомы или группы атомов связаны с карбонильной группой. Карбонильная группа– группа из атомов С и О, связанных двойной связью: 
Карбонильные соединения делят на два класса – альдегиды и кетоны.
Альдегиды соединения, в которых карбонильная группа связана хотя бы с одним атомом водорода | Кетоны соединения, в которых карбонильная группа связана только с атомами углерода |
|
|

Карбоновые кислоты. Строение, физические свойства, номенклатура
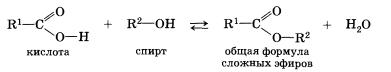
Карбоновыми кислотами называются соединения, содержащие карбоксильную группу
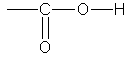
Классификация. По числу карбоксильных групп карбоновые кислоты делят на монокарбоновые, или одноосновные (одна группа -СООН), дикарбоновые, или двухосновные (две группы -СООН) и т.д. В зависимости от строения углеводородного радикала, с которым связана карбоксильная группа, карбоновые кислоты бывают алифатическими (например, уксусная или акриловая), алициклическими (например, циклогексанкарбоновая) или ароматическими (бензойная, фталевая). В таблице указаны некоторые представители карбоновых кислот.
Формула | Систематическое Название | Тривиальное Название |
Монокарбоновые кислоты | ||
HCOOH | метановая | муравьиная |
CH3COOH | этановая | уксусная |
C2H5COOH | пропановая | пропионовая |
C6H5COOH | бензойная | - |
CH3(CH2)16COOH | октадециловая | стеариновая |
CH2=CH-COOH | пропеновая | акриловая |
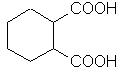
Дикарбоновые кислоты | ||
HOOC-COOH | этандиовая | щавелевая |
HOOC-CH2-COOH | пропандиовая | малоновая |
HOOC-CH2CH2-COOH | бутандиовая | янтарная |
| бензол-1,2- дикарбоновая | фталевая |
| бензол-1,4- дикарбоновая | терефталевая |
Получение и применение карбоновых кислот
Способы получения.
1. Окисление альдегидов и первичных спиртов — общий способ получения карбоновых кислот. В качестве окислителей применяются KМnО4 и K2Сr2О7.
| [O] | [O] | |||
| R-CH2-OH | → | R-CH=O | → | R-CO-OH |
| спирт | альдегид | кислота | ||
2 Другой общий способ — гидролиз галогензамещенных углеводородов, содержащих, три атома галогена у одного атома углерода. При этом образуются спирты, содержащие группы ОН у одного атома углерода — такие спирты неустойчивы и отщепляют воду с образованием карбоновой кислоты:
| ЗNаОН | ||||
| R-CCl3 | → | [R-C(OH)3] | → | R-COOH + Н2О |
| -3NaCl |
3. Получение карбоновых кислот из цианидов (нитрилов) — это важный способ, позволяющий наращивать углеродную цепь при получении исходного цианида. Дополнительный атом углерода вводят в состав молекулы, используя реакцию замещения галогена в молекуле галогенуглеводорода цианидом натрия, например:
СН3-Вr + NaCN → CH3 - CN + NaBr.
Решение задач по теме Карбонильные соединения. Карбоновые кислоты. Эфиры
Здесь буду размещать задания из открытого банка заданий по теме Карбонильные соединения с решениями и пояснениями








 + 2Ag (NH3)2ОН ® NH4HCO3 + 3NH3 + 2Ag + H2O.
+ 2Ag (NH3)2ОН ® NH4HCO3 + 3NH3 + 2Ag + H2O. характерна реакция на альдегиды. Например, реакция с гидроксидом меди приведет к образованию оксида меди красного цвета.
характерна реакция на альдегиды. Например, реакция с гидроксидом меди приведет к образованию оксида меди красного цвета.

 ⇆
⇆  +H+
+H+