| Главная » Статьи » 10 класс » Карбонильные соединения. Карбоновые кислоты |
Альдегиды и кетоны
АЛЬДЕГИДЫ И КЕТОНЫ – органические соединения, содержащие фрагмент >C=O (углерод, связанный двойной связью с кислородом, его называют карбонильным). У альдегидов карбонильный углерод соединен с атомом Н и органической группой R (общая формула RHC=O), а в кетонах – с двумя органическими группами (общая формула R2С=О).
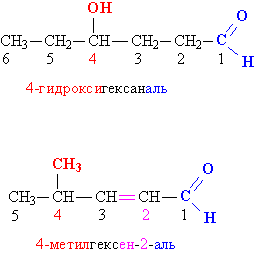
Номенклатура альдегидов и кетонов. Группу –(Н)С=О называют альдегидной, для связывания с органическими группами у нее есть всего одна свободная валентность, это позволяет ей находится только на конце углеводородной цепи (но не в середине). При составлении названия альдегида указывается название соответствующего углеводорода, к которому добавляется суффикс «аль», например, метаналь Н2С=О, этаналь Н3СС(Н)=О, пропаналь Н3ССН2С(Н)=О. В более сложных случаях углеродную цепь группы R нумеруют, начиная с карбонильного углерода, затем с помощью числовых индексов указывают положение функциональных групп и различных заместителей.
Рис. 1. НОМЕНКЛАТУРА АЛЬДЕГИДОВ. Замещающие и функциональные группы, а также соответствующие им цифровые индексы выделены различающимися цветами.
Для некоторых альдегидов часто используют тривиальные (упрощенные) названия, сложившиеся исторически, например, формальдегид Н2С=О, ацетальдегид Н3СС(Н)=О, кротоновый альдегид СН3СН=CHC(H)=O.
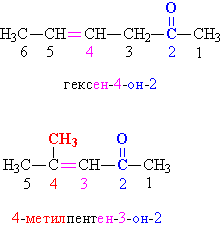
В отличие от альдегидной, кетонная группа >C=O может находиться также в середине углеводородной цепи, поэтому в простых случаях указывают названия органических групп (упоминая их в порядке увеличения) и добавляют слово «кетон»: диметилкетон CH3–CO–CH3, метилэтилкетон CH3CH2–CO–CH3. В более сложных случаях положение кетонной группы в углеводородной цепи указывают цифровым индексом, добавляя суффикс «он». Нумерацию углеводородной цепи начинают с того конца, который находится ближе к кетонной группе (рис. 2).
Рис. 2. НОМЕНКЛАТУРА КЕТОНОВ. Замещающие и функциональные группы и соответствующие им цифровые индексы выделены различными цветами.
Для простейшего кетона CH3–CO–CH3 принято тривиальное название – ацетон.
Химические свойства альдегидов и кетонов
определяются особенностями карбонильной группы >C=O, обладающей полярностью – электронная плотность между атомами С и О распределена неравномерно, сдвинута к более электроотрицательному атому О. В результате карбонильная группа приобретает повышенную реакционную способность, что проявляется в разнообразных реакциях присоединения по двойной связи. Во всех случаях кетоны менее реакционноспособны, чем альдегиды, в частности, из-за пространственных затруднений, создаваемых двумя органическими группами R, наиболее легко участвует в реакциях формальдегид Н2С=О.
1. Присоединение по двойной связи С=О.
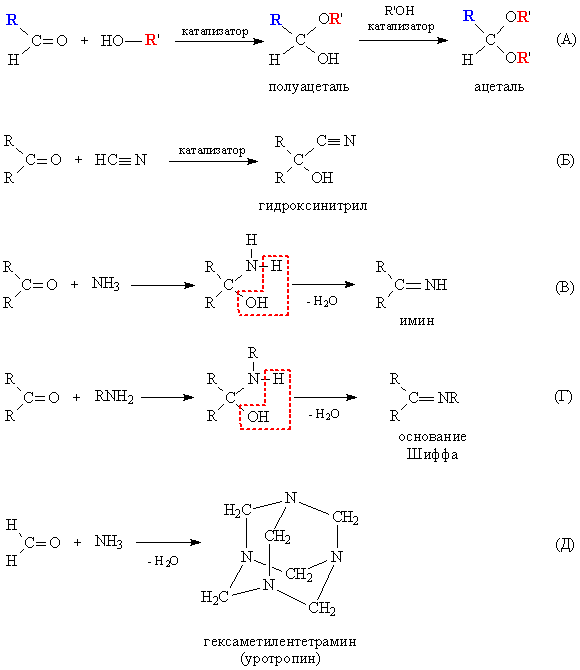
При взаимодействии со спиртами альдегиды образуют полуацетали – соединения, содержащие одновременно алкокси- и гидрокси-группу у одного атома углерода: >C(OH)OR. Полуацетали могут далее реагировать с еще одной молекулой спирта, образуя полные ацетали – соединения, где у одного атома углерода находятся одновременно две RО-группы: >C(OR)2. Реакцию катализируют кислоты и основания (рис. 3А). В случае кетонов присоединение спиртов к двойной связи в С=О затруднено.
Сходным образом альдегиды и кетоны реагируют с синильной кислотой HCN, образуя гидроксинитрилы – соединения, содержащие у одного атома углерода ОН- и CN-группу: >C(OH)CєN (рис. 3Б). Реакция примечательна тем, что позволяет увеличивать углеродную цепь (возникает новая связь С-С).
Точно так же (раскрывая двойную связь С=О) аммиак и амины реагируют с альдегидами и кетонами, продукты присоединения неустойчивы и конденсируются с выделением воды и образованием двойной связи C=N. В случае аммиака получаются имины (рис. 3В), а из аминов образуются так называемые основания Шиффа – соединения, содержащие фрагмент >C=NR (рис. 3Г). Продукт взаимодействия формальдегида с аммиаком несколько иной – это результат циклизации трех промежуточных молекул, в результате получается каркасное соединение гексаметилентетрамин, используемое в медицине как препарат уротропин (рис. 3Д).
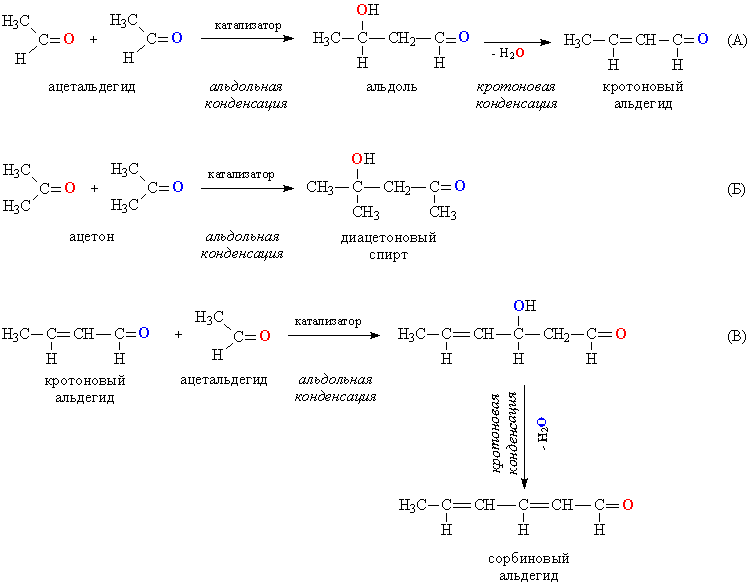
2. Реакции конденсации. Для альдегидов и кетонов возможна конденсация, проходящая между двумя молекулами одного и того же соединения. При такой конденсации альдегидов двойная связь одной из молекул раскрывается, образуется соединение, содержащее одновременно альдегидную и ОН-группу, называемое альдолем (альдегидоспирт). Протекающую конденсацию называют, соответственно, альдольной, эту реакцию катализируют основания (рис. 4А). Полученный альдоль может далее конденсироваться с образованием двойной связи С=С и выделением конденсационной воды. В итоге получается ненасыщенный альдегид (рис. 4А, кротоновой альдегид). Такую конденсацию называют кротоновой по названию первого соединения в ряду ненасыщенных альдегидов. Кетоны также способны участвовать в альдольной конденсации (рис. 4Б), а вторая стадия – кротоновая конденсация, для них затруднена. В альдольной конденсации могут совместно участвовать молекулы различных альдегидов, а также одновременно альдегид и кетон, во всех случаях происходит удлинение углеродной цепи. Получившийся на последней стадии (рис. 4А) кротоновый альдегид, обладая всеми свойствами альдегидов, может далее участвовать в альдольной и кротоновой конденсации при взаимодействии с очередной порцией ацетальдегида, из которого он и был получен (рис. 4В). Таким способом можно удлинять углеводородную цепь, получая соединения, в которых чередуются простые и двойные связи: –СН=СН–СН=СН–.
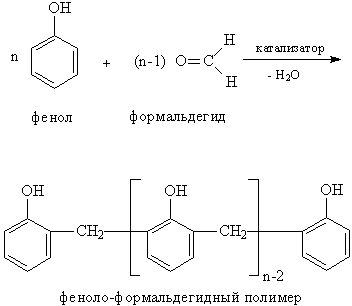
Конденсация альдегидов и кетонов с фенолами идет с удалением карбонильного атома О (в виде воды), а метиленовая группа СН2 или замещенная метиленовая группа (СНR либо СR2) встраивается между двумя молекулами фенола. Наиболее широко эту реакцию применяют для получения фенолоформальдегидных смол (рис. 5.).
Рис. 5. КОНДЕНСАЦИЯ ФЕНОЛА С ФОРМАЛЬДЕГИДОМ
3. Полимеризация карбонильных соединений протекает с раскрытием двойной связи С=О и свойственна, в основном, альдегидам. При упаривании в вакууме водных растворов формальдегида образуется смесь циклических соединений (в основном, триоксиметилен) и линейных продуктов с незначительной длиной цепи n = 8–12 (параформ). Полимеризацией циклического продукта получают полиформальдегид (рис. 6) – полимер с высокой прочностью и хорошими электроизоляционными свойствами, используемый как конструкционный материал в машино- и приборостроении.
| Всего комментариев: 0 | |