Свойства элементов и простых веществ галогенов
1. Свойства химических элементов галогенов
К галогенам относят фтор, хлор, бром, йод и астат. Они образуют VIIА-группу Периодической системы химических элементов.

Рис. 1. Химические элементы-галогены и образованные ими простые вещества
 NaaB4
NaaB4 Химия неметаллов
Химия неметаллов 0
0 1326
1326
Химические свойства галогенов - фтора, хлора, брома, йода и астата
Свободные галогены проявляют чрезвычайно высокую химическую активность. Они вступают во взаимодействие почти со всеми простыми веществами, окисляют ряд сложных веществ.
Так, расплавленный металлический натрий в атмосфере хлора сгорает с ослепительной вспышкой, а на стенках сосуда появляется белый налет хлорида натрия:
2Na + Cl2 = 2NaCl
 NaaB4
NaaB4 Химия неметаллов
Химия неметаллов 0
0 1208
1208
Сероводород и сульфиды
Сероводород (H2S) – бесцветный газ с резким запахом гниющего белка. В природе встречается вводах минеральных ключей вулканических газах, гниении отбросов, а также при разложении белков погибших растений и животных.
Получение:
1) прямой синтез из элементов, при температуре 600 °C;
2) воздействием на сульфиды натрия и железа соляной кислотой.
Физические свойства: сероводород тяжелее воздуха, очень ядовит. Сжижение его происходит при -60,8 °C, затвердение – при -85,7 °C. Легко воспламеняется на воздухе. Растворим в воде – при температуре 20 °C в 1 литре воды можно растворить 2,5 литра сероводорода, при этом образуется сероводородная кислота.
 NaaB4
NaaB4 Химия неметаллов
Химия неметаллов 0
0 647
647
Кислородсодержащие соединения галогенов
Степени окисления. Все галогены в галогенидных соединениях имеют степень окисления — 1. Такое состояние окисления для фтора в соединениях вообще является единственно возможным. Другие галогены могут существовать еще в состояниях с положительными степенями окисления. Эти состояния возникают в результате промотирования электронов с  -орбиталей атомов галогенов на их вакантные (незанятые электронами) d-орбитали (рис. 16.2). В атомах галогенов d-орбитали имеют сравнительно низкую энергию и поэтому оказываются легко доступными для заселения промотированными электронами.
-орбиталей атомов галогенов на их вакантные (незанятые электронами) d-орбитали (рис. 16.2). В атомах галогенов d-орбитали имеют сравнительно низкую энергию и поэтому оказываются легко доступными для заселения промотированными электронами.
 NaaB4
NaaB4 Химия неметаллов
Химия неметаллов 0
0 1116
1116
Азот
Строение и свойства атомов. Элемент азот N — первый представитель главной подгруппы V группы Периодической системы. Его атомы содержат на внешнем энергетическом уровне пять электронов, из которых три электрона неспаренные (вспомните правило «8-N»). Отсюда следует, что атомы этих элементов могут присоединять три электрона, завершая внешний энергетический уровень, и вследствие этого приобретают степень окисления -3, например в соединениях с водородом — аммиаке NН3 и с металлами — нитридах Li3N, Mg3N2 и др.
 NaaB4
NaaB4 Химия неметаллов
Химия неметаллов 0
0 1195
1195
Аммиак и соли аммония
В лаборатории аммиак обычно получают, нагревая хлорид аммония  с гашеной известью
с гашеной известью  . Реакция выражается уравнением
. Реакция выражается уравнением
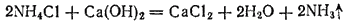
Выделяющийся аммиак содержит пары воды. Для осушения его пропускают через натронную известь (смесь извести с едким натром).
 NaaB4
NaaB4 Химия неметаллов
Химия неметаллов 0
0 2122
2122
Оксиды азота
Оксид  , или закись азота,
, или закись азота,  получается при нагревании нитрата аммония:
получается при нагревании нитрата аммония:
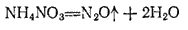
Оксид азота (I) представляет собою бесцветный газ со слабым запахом и сладковатым вкусом. Он мало растворим в воде: один объем воды при  растворяет 0,63 объема
растворяет 0,63 объема  .
.
 NaaB4
NaaB4 Химия неметаллов
Химия неметаллов 0
0 1874
1874
Азотная кислота и ее соли
Азотная кислота и ее соли. Чистая HNO3 бесцветная жидкость, на воздухе «дымит», смешивается с водой. На свету частично разлагается, приобретая бурую окраску.
Получение.
1. В лаборатории азотную кислоту получают при взаимодействии безводных нитратов с концентрированной серной кислотой:
Ba (NO3)2 + H2SO4 → BaSO4↓ + 2HNO3.
 NaaB4
NaaB4 Химия неметаллов
Химия неметаллов 0
0 668
668
Фосфор и его соединения
Строение и свойства атомов. Следующий после азота представитель главной подгруппы V группы Периодической системы — элемент-неметалл фосфор Р. Атомы фосфора по сравнению с атомами азота имеют больший радиус, меньшее значение электроотрицательности, а значит, более выраженные восстановительные свойства. Соединения со степенью окисления -3 атома фосфора встречаются реже, чем у азота (только в фосфидах — соединениях фосфора с металлами, например Са3Р2, Nа3Р). Чаще фосфор проявляет в соединениях степень окисления +5. А вот его соединение с водородом — фосфин РН3 — тот редкий случай, когда ковалентная связь между атомами разных элементов неполярна в силу того, что электроотрицательности фосфора и водорода имеют почти одинаковые значения.
 NaaB4
NaaB4 Химия неметаллов
Химия неметаллов 0
0 1249
1249
Углерод
Углерод (С) – типичный неметалл; в периодической системе находится в 2-м периоде IV группе, главной подгруппе. Порядковый номер 6, Ar = 12,011 а.е.м., заряд ядра +6. Физические свойства: углерод образует множество аллотропных модификаций: алмаз – одно из самых твердых веществ, графит, уголь, сажа.
Химические свойства: электронная конфигурация: 1s22s22p2. На электронной оболочке атома – 6 электронов; на внешнем валентном уровне – 4 электрона. Наиболее характерные степени окисления: +4, +2 – в неорганических соединениях, – 4, -2 – в органических. Углерод в любом гибридном состоянии способен использовать все свои валентные электроны и орбитали. У 4-валентного углерода нет неподеленных электронных пар и нет свободных орбиталей – углерод химически относительно устойчив. Характерно несколько типов гибридизации: sp, sp2, sp3. При низких температурах углерод инертен, но при нагревании его активность возрастает. Углерод – хороший восстановитель, но соединяясь с металлами и образуя карбиды, он выступает окислителем
 NaaB4
NaaB4 Химия неметаллов
Химия неметаллов 0
0 649
649