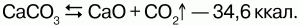| Главная » Статьи » 8 класс » Вещества и их превращения |
| В категории материалов: 18 Показано материалов: 1-10 |
Страницы: 1 2 » |
Сортировать по: Дате · Названию · Рейтингу · Комментариям · Просмотрам
История открытия кислорода
У кислорода интересная история открытия. Он,можно сказать был открыт трижды. Задержке его открытия способствовали свойства кислорода, такие как газообразность, бесцветность, отсутствие вкуса и запаха.
Ученые предполагали о существовании данного вещества.
Интересным фактом является то, что впервые кислород выделили не химики. Это сделал изобретатель подводной лодки К. Дреббель в начале XVII в. Этот газ он использовал для дыхания в лодке, при погружении в воду. Но работы изобретателя были засекречены. Поэтому работы К. Дреббеля не сыграли большой работы для развития химии.
Открыт же был кислород практически одновременно, независимо друг от друга, великими химиками XVIII века шведом Карлом Вильгельмом Шееле и англичанином Джозефом Пристли. Шееле выделил кислород немного ранее, однако его трактат «О воздухе и огне», где имелись данные о кислороде, был опубликован позже, чем сообщение об открытии Пристли. Они открыли новый газ. Только и всего. И до конца жизни остались преданными теории флогистона, которая в конце XVIII века стала тормозом для развития науки.
Металлы в природе. Получение металлов
Только мало активные в химическом отношении металлы встречаются в природе в свободном состоянии, поэтому их называют «самородными металлами». Это золото, платина («благородные металлы»), реже Ag, Cu, Hg. Большинство металлов образуют минералы, основой которых являются различные соединения: оксиды, чаще гидратированные (Fe2O3, Fe3O4, Al2O3, SnO2, MnO2); сульфиды и дисульфиды (ZnS, PbS, Ag2S, FeS, FeS2), карбонаты (CaCO3, MgCO3, FeCO3) и другие.
Природные минералы и горные породы, содержащие металлы в таких соединениях и в таких концентрациях, при которых их переработка с целью получения металла экономически целесообразна, называют рудами.
Отрасль промышленности, производящая металлы и их сплавы из природных руд и другого сырья, например, металлического лома, называют металлургией. Различают пирометаллургические (то есть процессы при высоких температурах) игидрометаллургические (процессы в водных растворах) способы получения металлов.
Применение металлов и сплавов
Металл является одним из самых необходимых материалов в промышленности, строительстве, сельском хозяйстве и иных видах жизнедеятельности человека. Несмотря на то, что сегодня все более популярным материалом становится пластик, трубы из него могут использоваться только в помещениях, а конструкции, проходящие под землей, можно изготавливать только из металла.
Чаще всего в промышленности и строительстве используются не чистые металлы, а их сплавы, в основе которых лежит какой-либо элемент и разнообразные добавки, улучшающие его качества – надежность, прочность и т.д. Самыми распространенными сплавами являются сталь, чугун, а также материалы, в основе которых лежит медь и алюминий.
Сталь является самым востребованным металлом. Подобный вывод можно сделать, проанализировав ежегодные объемы производства того или иного металла. В большинстве случаев, сталь представляет собой сплав железа с углеродом, количество которого достигает двух процентов. Сплавы стали подразделяются на несколько видов: малоуглеродистые, уровень углерода в которых не превышает 0,25%, высокоуглеродистые с содержанием углерода свыше 0,55% и легированные, дополненные никелем, хромом, ванадием. Для того чтобы значение стали в жизни человека стало для вас более явным, попробуйте вспомнить все металлические предметы, которые вы использовали за день, - ножи, бритву и т.д. все они изготовлены из стали.
Простые вещества — металлы и неметаллы
Среди простых веществ различают металлы и неметаллы. Вам известны многие металлы: железо, медь, алюминий, свинец, золото, серебро и другие. Знаете вы и некоторые неметаллы: серу, уголь, азот, кислород, водород, фосфор, кремний и другие.
Вы всегда сумеете отличить металл от неметалла по общим свойствам. Так, металлы при обычных условиях находятся в твердом состоянии, кроме металла ртути. Она жидкая. Металлы хорошо проводят тепло и электрический ток, поэтому из них делают провода. Они пластичны. Стержень из чистого металла можно согнуть, расплющить в пластинку, свернуть трубочкой. Металлы в чистом виде блестят.
Среди неметаллов есть вещества твердые (сера, уголь, фосфор, кремний), жидкие (бром) и газообразные (кислород, водород, азот). Твердые неметаллы хрупкие, не пластичные. Вы знаете, что кусок чистого угля, например, не согнешь, он раскрошится. Неметаллы плохо нагреваются, не проводят электрический ток. Только уголь обладает электрической проводимостью. Некоторые металлы добывают как простые вещества – золото, платину, реже ртуть, олово. Из неметаллов как полезное ископаемое находят самородную серу, уголь. Газы – кислород, азот – есть в составе атмосферного воздуха. Водород как простое вещество встречается в небольших количествах в верхних слоях атмосферы и как примесь в природных горючих газах.
Металлы образованы атомами химических элементов металлов. Тела, состоящие из металлов, обладают многими сходными свойствами. Медь, цинк, железо, алюминий и другие металлы имеют блеск, пластичность, быстро нагреваются, проводят электрический ток.
Неметаллы образованы атомами неметаллов. Кислород, сера, уголь, фосфор и другие неметаллы отличаются от металлов по всем свойствам.