| Главная » Статьи » 8 класс » Вещества и их превращения |
Получение кислорода
Большое количество кислорода используется в промышленности, в медицине, в других областях человеческой деятельности. Промышленные количества кислорода получают из жидкого воздуха. Сначала воздух сжимают мощными компрессорами – при этом он, как любой сжимаемый газ, сильно нагревается. Если вам приходилось энергично накачивать велосипедную камеру, то вы должны помнить, что корпус насоса и шланг нагреваются довольно заметно.
Сжатый воздух в больших баллонах-емкостях охлаждается. Затем его подвергают быстрому расширению через узкие каналы, снабженные турбинками для дополнительного отбора энергии у молекул газа. Эти устройства называются турбодетандерами. При расширении любого газа всегда происходит его охлаждение. Если газ был сжат очень сильно, то его расширение может привести к такому сильному охлаждению, что часть воздуха сжижается. Жидкий воздух собирают в специальные сосуды, называемые сосудами Дьюара (рис. 6-2).
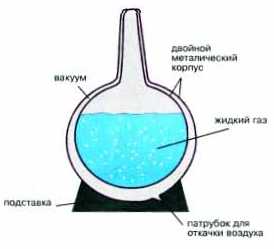
Рис. 6-2. Сосуд Дьюара для хранения и транспортировки сжиженных газов и его устройство. Из пространства между внутренней и внешней стенками сосуда откачан воздух. Вакуум практически не проводит тепло, поэтому жидкий газ, даже имея очень низкую температуру, может сохраняться в таком сосуде длительное время.
Как вы уже знаете, жидкий кислород кипит при более "высокой" температуре (-183 оС), чем жидкий азот (-196 оС). Поэтому при "нагревании" жидкого воздуха, когда температура этой очень холодной жидкости медленно повышается от -200 оС до -180 оС, прежде всего при -196 оС перегоняется азот (который опять сжижают) и только следом перегоняется кислород. Если такую перегонку жидких азота и кислорода произвести неоднократно, то можно получить весьма чистый кислород. Обычно его хранят в сжатом виде в стальных баллонах, окрашенных в голубой цвет. Характерная голубая окраска баллонов нужна для того, чтобы нельзя было спутать кислород с каким-нибудь другим сжатым газом.
Аппаратура для промышленного получения кислорода, как мы видим, очень сложна и энергоемка. В лаборатории кислород удобнее получать из его соединений с другими элементами.
 Чаще всего кислород получают нагреванием таких веществ (в состав которых кислород входит в связанном виде), как перманганат калия (марганцовка), хлорат калия (бертолетова соль), нитрат калия (селитра):
Чаще всего кислород получают нагреванием таких веществ (в состав которых кислород входит в связанном виде), как перманганат калия (марганцовка), хлорат калия (бертолетова соль), нитрат калия (селитра):
2 KMnO4 | = | K2MnO4 | + | MnO2 | + | O2 |
перманганаткалия | нагревание | манганаткалия | диоксидмарганца | кислород |
2 KClO3 | = | 2 KCl | + | 3 O2 |
хлорат калия | нагревание | хлоридкалия | кислород |
2 KNO3 | = | 2 KNO2 | + | O2 |
нитрат калия | нагревание | нитриткалия | кислород |
Удобно получать кислород в лаборатории из пероксида водорода:
2 H2O2 | = | 2 H2O | + | O2 |
пероксид водорода | катализатор | кислород |
Пероксид водорода обычно используется в виде 3%-ного водного раствора. Многие из вас знакомы с ним, потому что такой раствор применяется как дезинфицирующее средство при обработке царапин и мелких ран. Он мало устойчив и уже при стоянии медленно разлагается на кислород и воду. Попав на царапину или ранку, пероксид начинает выделять кислород гораздо интенсивнее (сильно пузырится, шипит). Дело здесь в том, что кровь содержит особые вещества (катализаторы), которые ускоряют реакцию разложения пероксида водорода. Катализаторы – это вещества, способные ускорять химические превращения, сами оставаясь при этом неизменными (более подробно о них рассказывается в следующей книге).
Катализаторами разложения Н2О2 могут служить многие вещества, в том числе и неорганические: диоксид марганца (MnO2), древесный уголь (углерод), железный порошок. Существуют и "антикатализаторы" – то есть вещества, замедляющие химическое превращение. Такие замедлители химических реакций называются ингибиторами. Например, фосфорная кислота Н3РО4 по каким-то причинам препятствует разложению пероксида водорода.
Интересен способ получения кислорода из пероксидов металлов, который раньше применяли на подводных лодках, потому что одновременно с выделением кислорода происходит поглощение углекислого газа:
2 Na2O2 | + | 2 CO2 | = | 2 Na2CO3 | + | O2 |
пероксид натрия | углекислый газ | сода | кислород |
На современных атомных подводных лодках, где имеется мощный и почти неисчерпаемый источник электрической энергии, есть возможность получать кислород разложением воды под действием электрического тока (электролизом воды):
2 H2O | = | 2 H2 | + | O2 |
электрический ток | водород | кислород |
** История открытия кислорода интересно переплетается с историей появления подводных лодок. Есть сведения, что кислород был открыт еще в XVII веке голландским ученым К. Дреббелем. Он использовал этот газ для дыхания в подводной лодке собственной конструкции. Но это открытие относилось к военной технике и держалось в секрете, поэтому не оказало никакого влияния на дальнейшие исследования.
До официального открытия кислорода химики, вероятно, уже получали этот газ разными способами, но не знали, что держат в руках новый элемент.
Первооткрывателями кислорода считаются шведский химик Карл Шееле и английский естествоиспытатель Джозеф Пристли. Шееле получил кислород несколько раньше, но опубликовал свои исследования позднее, чем Пристли.
Карл Шееле по профессии был аптекарем, а по призванию – химиком-экспериментатором. В течение многих лет он изучал разложение нагреванием множества веществ (среди которых была и селитра KNO3) и получил газ, который поддерживал дыхание и горение. Свои исследования он опубликовал в 1777 году в книге "Химический трактат о воздухе и огне".
Джозеф Пристли был священником, а в естественных науках его интересовала прежде всего "пневмохимия", т.е. изучение свойств различных газов. Он был первым, кто специально растворил газ в воде и обнаружил, что вода стала удивительно вкусной. Так была изобретена газированная вода.
Затем Пристли, как и Шееле, стал изучать газы, выделяемые различными веществами при нагревании. Получаемый газ он выводил через трубку в сосуд, заполненный не водой, а ртутью. Пристли уже убедился в том, что вода слишком хорошо растворяет газы.
Среди веществ, разложение которых изучил Пристли, оказалось одно, известное еще алхимикам под названием "меркуриус кальцинатус пер се" или жженая ртуть. Это вещество на современном химическом языке называется оксидом ртути, а уравнение его разложения при нагревании выглядит следующим образом:
2 HgO | = | 2 Hg | + | O2 |
оксид ртути | нагревание | ртуть | кислород |
Вы можете теперь представить, как трудно было изучать химию во времена, когда химические формулы еще не были изобретены. То, что мы только что записали коротким химическим уравнением, Пристли описал в 1774 году следующим образом: "Я поместил под перевернутой банкой, погруженной в ртуть, немного порошка "меркуриус кальцинатус пер се". Затем я взял небольшое зажигательное стекло и направил лучи Солнца прямо внутрь банки на порошок. Из порошка стал выделяться воздух, который вытеснил ртуть из банки. Я принялся изучать этот воздух. И меня удивило, даже взволновало до глубины моей души, что в этом воздухе свеча горит лучше и светлее, чем в обычной атмосфере".
Разумеется, такое описание реакции выглядит весьма поэтично по сравнению с обычным химическим уравнением. Зато уравнение точнее и короче отражает суть произошедшей химической реакции, его легче понять и запомнить.
| Всего комментариев: 0 | |


