| Главная » Статьи » 11 класс » Типы химической связи |
| В категории материалов: 4 Показано материалов: 1-4 |
Сортировать по: Дате · Названию · Рейтингу · Комментариям · Просмотрам
Виды химической связи: ковалентная (полярная и неполярная), ионная, их сходство и различие.
- Химическая связь – это сила, соединяющая два или несколько взаимодействующих атомов в молекулы или другие частицы.
Причиной образования химических связей является стремление атомов металлов и неметаллов путём взаимодействия с другими атомами достичь более устойчивой электронной структуры, подобной структуре инертных газов.
Различают три основных вида связи: ковалентную полярную, ковалентную неполярную и ионную.
- Ковалентная связь – это химическая связь, осуществляемая с помощью общих электронных пар, например, при образовании молекулы водорода неспаренные электроны атомов водорода образуют одну общую электронную пару, т.е. одну химическую связь:
Н · + · Н ® Н ·· Н.
 NaaB4
NaaB4 Типы химической связи
Типы химической связи 0
0 2917
2917
ЕГЭ. Периодическая система химических элементов.Строение вещества
| 1. Периодически изменяются следующие свойства атомов: 1) заряд атомного ядра; 2) относительная атомная масса; 3) число электронов на внешнем энергетическом уровне; 4) число энергетических уровней. 1. (3). Число электронов на внешнем электронном слое изменяется от одного до восьми, после этого появляется новый электронный слой. | |||||||||||||||||||||||
2.В периоде с увеличением заряда атомного ядра у химических элементов наблюдается:
чем больше заряды, тем больше силы взаимодействия и ,как следствие, меньше расстояние между заряженными частицами. | |||||||||||||||||||||||
| 3) Наименьшим значением энергии ионизации обладает атом следующего щелочноземельного металла: 1) стронций; 2) барий; 3) кальций; 4) радий. |
 NaaB4
NaaB4 Типы химической связи
Типы химической связи 0
0 1926
1926
Металлическая и водородная химические связи
Металлическая связь. Металлические кристаллы
 В металлах валентные электроны удерживаются атомами крайне слабо и способны мигрировать. Атомы, оставшиеся без внешних электронов, приобретают положительный заряд. Они образуют металлическую кристаллическую решётку.
В металлах валентные электроны удерживаются атомами крайне слабо и способны мигрировать. Атомы, оставшиеся без внешних электронов, приобретают положительный заряд. Они образуют металлическую кристаллическую решётку.Совокупность обобществлённых валентных электронов (электронный газ), заряженных отрицательно, удерживает положительные ионы металла в определённых точках пространства - узлах кристаллической решётки, например, металла серебро.
Внешние электроны могут свободно и хаотично перемещаться, поэтому металлы характеризуются высокой электропроводностью (особенно золото, серебро, медь, алюминий).
 NaaB4
NaaB4 Типы химической связи
Типы химической связи 0
0 2058
2058
Типы кристаллических решёток.
Твердые вещества, как правило, имеют кристаллическое строение. Оно характеризуется правильным расположением частиц в строго определенных точках пространства. При мысленном соединении этих точек пересекающимися прямыми линиями образуется пространственный каркас, который называют кристаллической решеткой.
Точки, в которых размещены частицы, называются узлами кристаллической решетки. В узлах воображаемой решетки могут находиться ионы, атомы или молекулы. Они совершают колебательные движения. С повышением температуры амплитуда колебаний возрастает, что проявляется в тепловом расширении тел.
В зависимости от вида частиц и характера связи между ними различают четыре типа кристаллических решеток: ионные, атомные, молекулярные и металлические.
Кристаллические решетки, состоящие из ионов, называются ионными. Их образуют вещества с ионной связью. Примером может служит кристалл хлорида натрия, в котором, как уже отмечалось, каждый ион натрия окружен шестью хлорид-ионами, а каждый хлорид-ион - шестью ионами натрия. Такому расположению соответствует наиболее плотная упаковка, если ионы представить в виде шаров, размещенных в кристалле . Очень часто кристаллические решетки изображают, как показано на рис 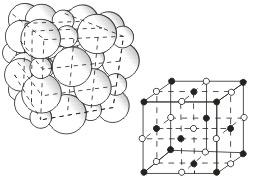 , где указывается только взаимное расположение частиц, но не их размеры.
, где указывается только взаимное расположение частиц, но не их размеры.
 NaaB4
NaaB4 Типы химической связи
Типы химической связи 0
0 1439
1439