| Главная » Статьи » 11 класс |
| В разделе материалов: 31 Показано материалов: 21-30 |
Страницы: « 1 2 3 4 » |
Периодический закон и Периодическая система химических элементов
Основной закон химии - Периодический закон был открыт Д.И. Менделеевым в 1869 году в то время, когда атом считался неделимым и о его внутреннем строении ничего не было известно.
В основу Периодического закона Д.И. Менделеев положил атомные массы (ранее - атомные веса) и химические свойства элементов.
Расположив 63 известных в то время элемента в порядке возрастания их атомных масс, Д.И. Менделеев получил естественный (природный) ряд химических элементов, в котором он обнаружил периодическую повторяемость химических свойств.
Например, свойства типичного металла литий Li повторялись у элементов натрий Na и калий K, свойства типичного неметалла фтор F - у элементов хлор Cl,бром Br, иод I.
У некоторых элементов Д.И. Менделеев не обнаружил химических аналогов (например, у алюминия Al и кремния Si), поскольку такие аналоги в то время были еще неизвестны. Для них он оставил в естественном ряду пустые места и на основе периодической повторяемости предсказал их химические свойства.
После открытия соответствующих элементов (аналога алюминия - галлия Ga, аналога кремния - германия Ge и др.) предсказания Д.И. Менделеева полностью подтвердились.
Периодический закон в формулировке Д.И. Менделеева:
| Свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных весов элементов. |
|---|
На основе Периодического закона Д.И. Менделеев создал Периодическую систему химических элементов.
Строение атома
При химических реакциях ядра атомов остаются без изменений, изменяется лишь строение электронных оболочек вследствие перераспределения электронов между атомами. Способностью атомов отдавать или присоединять электроны определяются его химические свойства.
Электрон имеет двойственную (корпускулярно-волновую) природу. Благодаря волновым свойствам электроны в атоме могут иметь только строго определенные значения энергии, которые зависят от расстояния до ядра. Электроны, обладающие близкими значениями энергии образуют энергетический уровень. Он содержит строго определенное число электронов - максимально 2n2. Энергетические уровни подразделяются на s-, p-, d- и f- подуровни; их число равно номеру уровня.
Квантовые числа электронов
Состояние каждого электрона в атоме обычно описывают с помощью четырех квантовых чисел: главного (n), орбитального (l), магнитного (m) и спинового (s). Первые три характеризуют движение электрона в пространстве, а четвертое - вокруг собственной оси.
Типы кристаллических решёток.
Твердые вещества, как правило, имеют кристаллическое строение. Оно характеризуется правильным расположением частиц в строго определенных точках пространства. При мысленном соединении этих точек пересекающимися прямыми линиями образуется пространственный каркас, который называют кристаллической решеткой.
Точки, в которых размещены частицы, называются узлами кристаллической решетки. В узлах воображаемой решетки могут находиться ионы, атомы или молекулы. Они совершают колебательные движения. С повышением температуры амплитуда колебаний возрастает, что проявляется в тепловом расширении тел.
В зависимости от вида частиц и характера связи между ними различают четыре типа кристаллических решеток: ионные, атомные, молекулярные и металлические.
Кристаллические решетки, состоящие из ионов, называются ионными. Их образуют вещества с ионной связью. Примером может служит кристалл хлорида натрия, в котором, как уже отмечалось, каждый ион натрия окружен шестью хлорид-ионами, а каждый хлорид-ион - шестью ионами натрия. Такому расположению соответствует наиболее плотная упаковка, если ионы представить в виде шаров, размещенных в кристалле . Очень часто кристаллические решетки изображают, как показано на рис 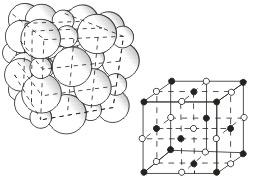 , где указывается только взаимное расположение частиц, но не их размеры.
, где указывается только взаимное расположение частиц, но не их размеры.
 NaaB4
NaaB4 Типы химической связи
Типы химической связи 0
0 1520
1520
Уравнения окислительно-восстановительных реакций
Многие химические реакции уравниваются простым подбором коэффициентов. Но иногда возникают сложности: количество атомов какого-нибудь элемента в левой и правой частях уравнения никак не удается сделать одинаковым без того, чтобы не нарушить "равновесия" между атомами других элементов.
Чаще всего такие сложности возникают в уравнениях окислительно-восстановительных реакций. Для их уравнивания используют несколько способов, из которых мы пока рассмотрим один – метод электронного баланса.
Напишем уравнение реакции между алюминием и кислородом:
Al + O2 = Al2O3
Пусть вас не вводит в заблуждение простота этого уравнения. Наша задача – разобраться в методе, который в будущем позволит вам уравнивать гораздо более сложные реакции.
Фосфор
| P фосфор |
ФОСФОР (лат. Phosphorus), Р, химический элемент V группы периодической системы Менделеева, атомный номер 15, атомная масса 30,97376.
Свойства:
Фосфор образует несколько аллотропных модификаций, которые заметно различаются по свойствам. Белый фосфор - мягкое кристаллическое вещество. Состоит из молекул P4. Плавится при температуре 44,1°С. Очень хорошо растворим в сероуглероде CS2. Черезвычайно ядовит и легко загорается.
Электролиз
Этот окислительно-восстановительный процесс протекает на электродах при прохождении постоянного электрического тока через растворы или расплавы электролитов.
На отрицательно заряженном электроде - катоде происходит электрохимическое восстановление частиц (атомов, молекул, катионов), а на положительно заряженном электроде - аноде идет электрохимическое окисление частиц (атомов, молекул, анионов).
