| Главная » Статьи » 9 класс |
| В разделе материалов: 61 Показано материалов: 1-10 |
Страницы: 1 2 3 ... 6 7 » |
Азот
Строение и свойства атомов. Элемент азот N — первый представитель главной подгруппы V группы Периодической системы. Его атомы содержат на внешнем энергетическом уровне пять электронов, из которых три электрона неспаренные (вспомните правило «8-N»). Отсюда следует, что атомы этих элементов могут присоединять три электрона, завершая внешний энергетический уровень, и вследствие этого приобретают степень окисления -3, например в соединениях с водородом — аммиаке NН3 и с металлами — нитридах Li3N, Mg3N2 и др.
 NaaB4
NaaB4 Химия неметаллов
Химия неметаллов 0
0 1509
1509
Азотная кислота и ее соли
Азотная кислота и ее соли. Чистая HNO3 бесцветная жидкость, на воздухе «дымит», смешивается с водой. На свету частично разлагается, приобретая бурую окраску.
Получение.
1. В лаборатории азотную кислоту получают при взаимодействии безводных нитратов с концентрированной серной кислотой:
Ba (NO3)2 + H2SO4 → BaSO4↓ + 2HNO3.
 NaaB4
NaaB4 Химия неметаллов
Химия неметаллов 0
0 754
754
Азотсодержащие органические соединения
1. Состав и номенклатура аминов
В большинстве природных органических соединений азот входит в состав NH2-аминогруппы. Органические вещества, молекулы которых содержат аминогруппу, называются аминами. Строение молекул аминов аналогично строению аммиака, и поэтому свойства этих веществ сходны.
Аминами называют производные аммиака, в молекулах которого один или несколько атомов водорода замещены углеводородными радикалами. Общая формула аминов – R-NH2.
 NaaB4
NaaB4 Органические вещества
Органические вещества 0
0 1939
1939
Аминокислоты. Белки
1. Состав и свойства аминокислот
Аминокислоты – это вещества, в молекулах которых содержатся одновременно аминогруппа -NH2 и карбоксильная группа -СООН. Например:


Аминоуксусная кислота (глицин) β-аминопропионовая кислота
Аминокислоты можно рассматривать как карбоновые кислоты, в молекулах которых атом водорода в радикале замещен аминогруппой. Общая формула аминокислот может быть записана так: H2N-CH-R-COOH, где R – углеводородный радикал.
 NaaB4
NaaB4 Органические вещества
Органические вещества 0
0 1926
1926
Аммиак и соли аммония
В лаборатории аммиак обычно получают, нагревая хлорид аммония  с гашеной известью
с гашеной известью  . Реакция выражается уравнением
. Реакция выражается уравнением
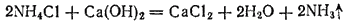
Выделяющийся аммиак содержит пары воды. Для осушения его пропускают через натронную известь (смесь извести с едким натром).
 NaaB4
NaaB4 Химия неметаллов
Химия неметаллов 0
0 2268
2268
Амфотерные гидроксиды и оксиды
Амфотерность (двойственность свойств) гидроксидов и оксидов многих элементов проявляется в образовании ими двух типов солей. Например, для гидроксида и оксида алюминия:
а) 2Al(OH)3 + 3SO3 = Al2(SO4)3 + 3H2O
Al2О3 + 3H2SO4 = Al2(SO4)3 + 3H2O
б) 2Al(OH)3 + Na2O = 2NaAlO2 + 3H2O (в расплаве)
Al2О3 + 2NaOH(т) = 2NaAlO2 + H2O (в расплаве)
В реакциях (а) Al(OH)3 и Al2О3 проявляют свойства оснóвных гидроксидов и оксидов, то есть они подобно щелочам реагируют с кислотами и кислотными оксидами, образуя соль, в которой алюминий является катионом Al3+.
Напротив, в реакциях (б) Al(OH)3 и Al2О3 выполняют функцию кислотных гидроксидов и оксидов, образуя соль, в которой атом алюминия AlIII входит в состав аниона (кислотного остатка) AlО2−.
Сам элемент алюминий проявляет в этих соединениях свойства металла и неметалла. Следовательно, алюминий - амфотерный элемент.
Жесткость воды
1. Жесткая вода
Если провести химический анализ жесткой воды, то можно увидеть, что в ней содержатся значительные количества растворимых солей кальция и магния. Именно присутствие этих солей и обуславливает жесткость воды. Мыло в жесткой воде плохо пенится, т.к. катионы кальция и магния образуют с мылом нерастворимые в воде соединения, и пена не образуется.
Но как катионы кальция и магния попадают в воду? Дождевые осадки, попадая на поверхность и протекая в недрах Земли, соприкасаются с минералами кальция и магния (это в основном карбонаты), вымывают из них мелкие частички. В воде, насыщенной углекислотой (вы знаете, что углекислый газ хорошо растворяется в воде), нерастворимые карбонаты кальция и магния превращаются в растворимые гидрокарбонаты (кислые соли):
СаСО3 + СО2 + Н2О = Са(НСО3)2
MgСО3 + СО2 + Н2О = Mg(НСО3)2
 NaaB4
NaaB4 Химия металлов
Химия металлов 0
0 1448
1448
Жиры и углеводы
1. Состав и строение жиров
Состав и строение жиров

Жиры – это сложные эфиры глицерина и высших жирных карбоновых кислот. Общая формула жиров выглядит следующим образом:
Твердые жиры образованы преимущественно высшими предельными карбоновыми кислотами – стеариновой С17Н35СООН, пальмитиновой С15Н31СООН и некоторыми другими.
 NaaB4
NaaB4 Органические вещества
Органические вещества 0
0 2069
2069
Закономерности изменения свойств химических элементов и их соединений по периодам и группам
1. Изменения свойств химических элементов и их соединений в группах:
 В группах все элементы имеют сходное электронное строение. Различий в наполнении внешнего энергетического уровня электронами нет.
В группах все элементы имеют сходное электронное строение. Различий в наполнении внешнего энергетического уровня электронами нет.
Ионная связь
Чисто ионной связью называется химически связанное состояние атомов, при котором устойчивое электронное окружение достигается путём полного перехода общей электронной плотности к атому более электроотрицательного элемента.
На практике полный переход электрона от одного атома к другому атому-паренеру по связи не реализуется, поскольку каждый элемент имеет большую или меньшую, но не нулевую, электроотрицательность, илюбая связь будет в некоторой степени ковалентной.
Ионная связь возможна только между атомами электроположительных и электроотрицательных элементов, находящихся в состоянии разноименно заряженных ионов.