|
Введение в органическую химию
|
В категории материалов: 4
Показано материалов: 1-4 |
|
Сортировать по:
Дате ·
Названию ·
Рейтингу ·
Комментариям ·
Просмотрам
Химическая реакция - это процесс, при котором из одних веществ получаются другие, отличающиеся от исходных веществ по составу или строению, по свойствам. Существует несколько классификаций химических реакций, основанных либо на параметрах самих реакций, либо на свойствах участвующих веществ. I. Классификация, основанная на агрегатном состоянии участвующих веществ. Реакция называется гомогенной (греч. «гомо-с» - одинаковый, «гениум» – рождать), т.е. одинаковый по рождению. Вещества, участвующие в реакции находятся в одном агрегатном состоянии: газообразном, твердом или жидком. В понятие «жидкое агрегатное состояние» входят и растворы веществ. Но между веществами не должно быть границы раздела фаз.
Все химическое реакции можно подразделить на 2 группы: обратимые и необратимые. Необратимые – это реакции, протекающие до конца, т.е. до полного израсходования одного из реагирующих веществ. Обратимыми –называются реакции, которые могут протекать в рассматриваемых условиях как в прямом, так и обратном направлениях. Когда хотят в самом уравнении реакции подчеркнуть обратимость её в данных условиях, то знак равенства заменяют двумя стрелками противоположного направления 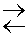 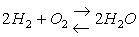
Вы знакомы с понятием "скорость" из курса физики. В общем виде скорость - это величина, показывающая как изменяется какая либо характеристика за единицу времени. Скорость химической реакции - это величина, показывающая как изменяются концентрации исходных веществ или продуктов реакции за единицу времени. Для оценки скорости необходимо изменение концентрации одного из веществ.
1. Наибольший интерес представляют реакции, протекающие в однородной (гомогенной) среде. Гомогенные системы (однородные) – газ/газ, жидкость/жидкость – реакции идут во всём объёме.
ХИМИЧЕСКОЕ РАВНОВЕСИЕ. Химические реакции заключаются во взаимодействии реагентов с образованием продуктов реакциию. Не следует, однако, полагать, что направление химической реакции только одно. В действительности, химические реакции протекают и в прямом, и в обратном направлениях: Реагенты Продукты Продукты |
Все химические реакции, в принципе, обратимы.
Это означает, что в реакционной смеси протекает как взаимодействие реагентов, так и взаимодействие продуктов. В этом смысле различие между реагентами и продуктами условное. Направление протекания химической реакции определяется условиями ее проведения (температурой, давлением,концентрацией веществ).
Многие реакции имеют одно преимущественное направление и для проведения таких реакций в противоположном направлении требуются экстремальные условия. В подобных реакциях происходит почти полное превращение реагентов в продукты.
Пример. Железо и сера при умеренном нагревании реагируют между собой с образованием сульфида железа (II), FeS при таких условиях устойчив и практически не разлагается на железо и серу
|
|