| Главная » Статьи » 8 класс » Первоначальные химические представления |
| В категории материалов: 22 Показано материалов: 1-10 |
Страницы: 1 2 3 » |
Сортировать по: Дате · Названию · Рейтингу · Комментариям · Просмотрам
Валентность химических элементов
Валентность – это способность атомов присоединять к себе определенное число других атомов.С одним атомом одновалентного элемента соединяется один атом другого одновалентного элемента (HСl). С атомом двухвалентного элемента соединяются два атома одновалентного (H2O) или один атом двухвалентного (CaO). Значит, валентность элемента можно представить как число, которое показывает, со сколькими атомами одновалентного элемента может соединяться атом данного элемента. Валентность элемента – это число связей, которое образует атом:
Закон постоянства состава веществ
К основным законам химии относится закон постоянства состава:
Всякое чистое вещество независимо от способа его получения всегда имеет постоянный качественный и количественный состав.
Атомно-молекулярное учение позволяет объяснить закон постоянства состава. Поскольку атомы имеют постоянную массу, то и массовый состав вещества в целом постоянен.
Закон постоянства состава впервые сформулировал французский ученый-химик Ж.Пруст в 1808 г
Количество вещества. Моль. Молярная масса.
В начале главы мы "записали" уравнение реакции горения метана в виде моделей молекул. На картинке хорошо видно, что для полного протекания реакции на каждую молекулу метана СН4 потребуется израсходовать две молекулы кислорода О2:
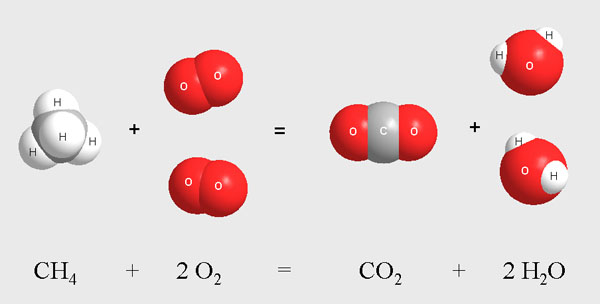
В воздухе всегда содержится достаточно кислорода для того, чтобы горение метана протекало именно так, как записано в уравнении реакции. Но представим на минуту, что нам надо сконструировать газовую горелку для подводных работ или двигатель космического корабля. Эти устройства должны работать без доступа атмосферного воздуха. Поэтому в таких конструкциях не обойтись без точного подсчета молекул реагентов, поступающих в зону горения (то есть в химическую реакцию). Например, если в камеру сгорания космического двигателя попадает больше молекул топлива, чем может прореагировать с окислителем, то это ведет к снижению тяги двигателя и к бесполезному расходованию части драгоценного топлива.
Массовая доля химического элемента в соединении
Массовая для элемента в данном веществе (w) – отношение относительной атомной массы данного элемента, умноженной на число его атомов в молекуле к относительной молекулярной массе вещества.
w(элемента) = (n· Ar(элемента) · 100%) /Mr(вещества) |
где
w – массовая доля элемента в веществе,
n– индекс в химической формуле,
Ar– относительная атомная масса,
Mr– относительная молекулярная масса вещества.
Массовые доли выражают в процентах или в долях:
w(элемента) = 20% или 0,2.
Относительная атомная масса химических элементов
ОТНОСИТЕЛЬНАЯ АТОМНАЯ МАССА
Историческая справка: Английский ученый Джон Дальтон (1766–1844) на своих лекциях демонстрировал студентам выточенные из дерева модели атомов, показывая, как они могут соединяться, образуя различные вещества. Когда одного из студентов спросили, что такое атомы, он ответил: «Атомы – это раскрашенные в разные цвета деревянные кубики, которые изобрел мистер Дальтон».
Конечно, Дальтон прославился не своими «кубиками» и даже не тем, что в двенадцатилетнем возрасте стал школьным учителем. С именем Дальтона связано возникновение современной атомистической теории. Впервые в истории науки он задумался о возможности измерения масс атомов и предложил для этого конкретные способы. Понятно, что непосредственно взвесить атомы невозможно. Дальтон рассуждал только о «соотношении весов мельчайших частиц газообразных и других тел», то есть об относительных их массах. И поныне, хотя масса любого атома в точности известна, ее никогда не выражают в граммах, так как это исключительно неудобно.
Периодический закон и Периодическая система химических элементов
1 марта (по новому стилю) 1869 г. считается датой открытия одного из важнейших законов химии – периодического закона. В середине XIX в. было известно 63 химических элемента, и возникла потребность в их классификации. Попытки такой классификации предпринимали многие ученые (У.Одлинг и Дж.А.Р.Ньюлендс, Ж.Б.А.Дюма и А.Э.Шанкуртуа, И.В.Деберейнер и Л.Ю.Мейер), но лишь Д.И.Менделееву удалось увидеть определенную закономерность, расположив элементы в порядке возрастания их атомных масс. Эта закономерность имеет периодический характер, поэтому Менделеев сформулировал открытый им закон следующим образом: свойства элементов, а также формы и свойства их соединений находятся в периодической зависимости от величины атомной массы элемента.
Предмет химии
Целью любой науки является познание окружающего нас мира, но предмет у каждой науки свой. Предметом химии являются вещества, их свойства и взаимные превращения.
Химики интересуются видом частиц, из которых состоят вещества, какие свойства этих частиц определяют свойства материи, какие из них определяют те химические преобразования, которые мы наблюдаем в природе и в экспериментах.
Химия отвечает на такие вопросы: Как построено вещество? Почему вещества отличаются друг от друга? Как происходит преобразование веществ?
Все, что окружает нас, состоит из веществ (материи). Эти вещества могут сильно отличаться по свойствам. Свойства материи - это цвет, плотность, прочность, электропроводность, и т.д. Например, некоторые вещи, сделанные из дерева или хлопка, могут гореть, в то время, как изделия из металла, не горят. Существует огромное количество различных субстанций, отличающихся друг от друга: дерево, металлы, вода, нефть, газ и т.д.
Как в химии изучают материю? Каким способом? Метод химии (или способ познания) основан на эксперименте с одной стороны и на теоретическом осмыслении результатов эксперимента с другой. Прикладной задачей химии, как правило, является получение вещества с заданным свойствами.