| Главная » Статьи » 9 класс |
| В разделе материалов: 61 Показано материалов: 21-30 |
Страницы: « 1 2 3 4 5 6 7 » |
Общие свойства металлов. Металлическая связь
Взаимодействие с кислородом
Для металлов характерны общие физические свойства: они обладают особенным металлическим блеском, высокой тепло- и электропроводностью, пластичностью.
Для металлов также характерны некоторые общие химические свойства. Важно запомнить, что в химических реакциях металлы выступают в качестве восстановителей: отдают электроны и повышают свою степень окисления. Рассмотрим некоторые реакции, в которых участвуют металлы.
ВЗАИМОДЕЙСТВИЕ С КИСЛОРОДОМ
Многие металлы могут вступать в реакцию с кислородом. Обычно продуктами этих реакций являются оксиды, но есть и исключения, о которых вы узнаете на следующем уроке. Рассмотрим взаимодействие магния с кислородом.
Магний горит в кислороде, при этом образуется оксид магния:
0 0 +2 -2
2Mg + O2 = 2MgO
 NaaB4
NaaB4 Химия металлов
Химия металлов 0
0 1324
1324
Окисление и восстановление
Сущность окисления и восстановления
Если через раствор хлорида меди (II) пропускать электрический ток, то на катоде выделится медь, а на аноде образуется хлор.

Рис. 1. Электролиз раствора хлорида меди(II)
Окислительно-восстановительные реакции
Понятие "окислительно-восстановительные реакции"
Рассмотрим реакцию магния с кислородом. Запишем уравнение этой реакции и расставим значения степеней окисления атомов элементов:
![]()
Как видно, атомы магния и кислорода в составе исходных веществ и продуктов реакции имеют различные значения степеней окисления. Запишем схемы процессов окисления и восстановления, происходящих с атомами магния и кислорода.
До реакции атомы магния имели степень окисления, равную нулю, после реакции - +2. Таким образом, атом магния потерял 2 электрона:
![]()
Оксиды азота
Оксид  , или закись азота,
, или закись азота,  получается при нагревании нитрата аммония:
получается при нагревании нитрата аммония:
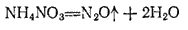
Оксид азота (I) представляет собою бесцветный газ со слабым запахом и сладковатым вкусом. Он мало растворим в воде: один объем воды при  растворяет 0,63 объема
растворяет 0,63 объема  .
.
 NaaB4
NaaB4 Химия неметаллов
Химия неметаллов 0
0 1871
1871
План характеристики элемента по положению в Периодической системе Д.И. Менделеева
План характеристики элемента по положению
в Периодической системе Д.И. Менделеева
1. Определите порядковый номер элемента, номер периода, группу, подгруппу. Укажите физический смысл параметров системы – порядкового номера, номера периода, номера группы, обоснуйте положение в подгруппе.
2. Составьте полную электронную формулу элемента, определите электронное семейство; отнесите простое вещество к классу металлов или неметаллов.
3. Изобразите графически электронную структуру элемента. Для многоэлектронных атомов (с порядковым номером больше 20) достаточно изобразить два последних уровня.
4. Укажите число и тип (s-, p-, d-) валентных электронов.
5. Изобразите графически все возможные спинвалентные состояния.
6. Перечислите возможные валентности и степени окисления.
7. Охарактеризуйте окислительно-восстановительные свойства элемента и способность к комплексообразованию – образованию дополнительных связей по донорно-акцепторному механизму.
8. Составьте формулы оксидов и гидроксидов для всех возможных валентных состояний. Опишите их физические свойства.
9. Укажите химический характер всех возможных оксидов и гидроксидов; подтвердите его уравнениями реакций.
10. Приведите формулу водородного соединения; опишите его физические свойства и химический характер.
11. Укажите массовые числа и распространенность в природе основных изотопов элемента; число протонов и нейтронов в ядре; атомные и ионные радиусы; энергии ионизации; энергии сродства к электрону; электроотрицательность и другие свойства элемента.
Повторение и обобщение темы "Химическая связь. Электролитическая диссоциация"
№ 1Из приведенного ниже перечня выпишите формулы веществ: а) с ковалентной неполярной связью; б) с ковалентной полярной связью и в) с ионной связью. BaCl2, NH3, O2, Cl2, NaCl, N2, HCl, Br2, I2, H2O, CO2, KBr, CaF2.
Решение:
Ионная связь образуется между атомами типичного металла и типичного неметалла (с разницей в значениях электроотрицательностей больше 2). Данному условию удовлетворяют следующие вещества: хлорид бария, хлорид натрия, бромид калия и фторид кальция: BaCl2, NaCl, KBr, CaF2.
Ковалентная неполярная связь возникает между атомами неметаллов с одинаковыми значениями относительной электроотрицательности. Это кислород, хлор, азот, бром и иод: O2, Cl2, N2, Br2, I2.
Ковалентная полярная связь возникает, как правило, между атомами с разными значениями относительной электроотрицательности (разница должна быть меньше 2). К таким соединениям относятся аммиак, хлороводород, вода, углекислый газ: NH3, NaCl, N2, HCl, H2O, CO2.
Повторение. Генетическая связь классов неорганических соединений
Химия – это наука о веществах, их свойствах и превращениях друг в друга.

Рис. 1. Генетическая связь классов неорганических соединений
Все неорганические вещества можно разделить на:
- Простые вещества
- Сложные вещества.
Простые вещества делятся на:
- Металлы
- Неметаллы
Сложные вещества можно разделить на:
- Оксиды
- Основания
- Кислоты
- Соли.
Попытки классификации химических элементов. Открытие периодического закона
Триады Дёберейнера
Попытки классификации химических элементов начались задолго до открытия Д.И.Менделеевым периодического закона. Естествоиспытатели в начале XIX сталкивались с большими трудностями в этом направлении, потому что химических элементов было известно всего 63, а атомные массы были определены для них неточно.
Триады Дёберейнера.

В 1829 году немецкий химик И.В.Дёберейнер заметил, что некоторые сходные по своим свойствам элементы можно объединить по три в группы. Он назвал их триадами.
Применение алюминия и его сплавов
1. Применение алюминия и его физические свойства, на которых оно основано
Алюминий называют «крылатым металлом». Такое название этот металл получил за свою легкость и широкое применение, в первую очередь, в самолетостроении. Алюминий прочно вошел в нашу жизнь: каждому с детства знакомы алюминиевая фольга, посуда, проволока. А ведь когда-то изделия из алюминия считались роскошью. Например, в 1852 году стоимость 1 кг алюминия была 1200 долларов, т.е. дороже золота. Почему же со временем цена на алюминий так упала?
Дело в том, что алюминий широко распространен в земной коре (8%), самый распространенный металл. Но для восстановления алюминия из руд необходимо затратить большое количество энергии. К концу 19 века разработали новый способ получения алюминия с помощью электролиза, ежегодное получение металла возросло в тысячи раз, и цена на него упала.
Алюминий очень устойчив по отношению к кислороду и воде. Эта устойчивость обусловлена образованием на его поверхности тонкой, но плотной и прочной оксидной пленки – Al2O3. Благодаря этому свойству алюминий и его сплавы нашли широкое применение в быту и промышленности. Вам хорошо известно о применении алюминия для изготовления кухонной посуды.
 NaaB4
NaaB4 Химия металлов
Химия металлов 0
0 2101
2101
Применение железа и его сплавов
1. Классификация сплавов железа с углеродом
Железо люди используют с древнейших времен. Однако железо в присутствии кислорода и воды легко подвергается коррозии. Поэтому чистое железо практически не используется, а применяются различные сплавы этого металла.
Сплавы железа с углеродом - это чугуны и стали. Эти сплавы классифицируются по содержанию в них углерода. В чугунах содержание углерода от 2 до 4% по массе, в небольших количествах в нем содержатся кремний, марганец, фосфор и сера.
 NaaB4
NaaB4 Химия металлов
Химия металлов 0
0 2765
2765