| Главная » Статьи » 8 класс |
| В разделе материалов: 59 Показано материалов: 11-20 |
Страницы: « 1 2 3 4 5 6 » |
Классификация неорганических веществ
Простые вещества. Молекулы состоят из атомов одного вида (атомов одного элемента). В химических реакциях не могут разлагаться с образованием других веществ.
Сложные вещества (или химические соединения). Молекулы состоят из атомов разного вида (атомов различных химических элементов). В химических реакциях разлагаются с образованием нескольких других веществ.
| Неорганические вещества | |
| Простые | Металлы |
| Неметаллы | |
| Сложные | Оксиды |
| Основания | |
| Кислоты | |
| Соли | |
Резкой границы между металлами и неметаллами нет, т.к. есть простые вещества, проявляющие двойственные свойства.
Аллотропия
Аллотропия - способность некоторых химических элементов образовывать несколько простых веществ, различающихся по строению и свойствам.
С - алмаз, графит, карбин.
O - кислород, озон.
S - ромбическая, моноклинная, пластическая.
P - белый, красный, чёрный.
Количество вещества. Моль. Молярная масса.
В начале главы мы "записали" уравнение реакции горения метана в виде моделей молекул. На картинке хорошо видно, что для полного протекания реакции на каждую молекулу метана СН4 потребуется израсходовать две молекулы кислорода О2:
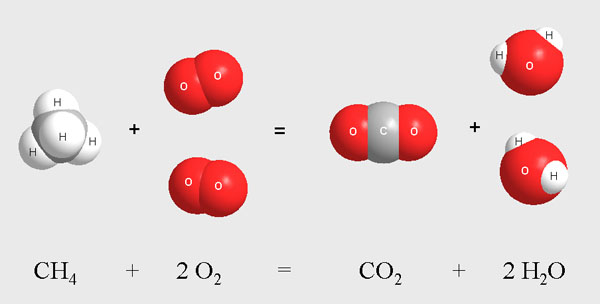
В воздухе всегда содержится достаточно кислорода для того, чтобы горение метана протекало именно так, как записано в уравнении реакции. Но представим на минуту, что нам надо сконструировать газовую горелку для подводных работ или двигатель космического корабля. Эти устройства должны работать без доступа атмосферного воздуха. Поэтому в таких конструкциях не обойтись без точного подсчета молекул реагентов, поступающих в зону горения (то есть в химическую реакцию). Например, если в камеру сгорания космического двигателя попадает больше молекул топлива, чем может прореагировать с окислителем, то это ведет к снижению тяги двигателя и к бесполезному расходованию части драгоценного топлива.
Массовая доля растворенного вещества в растворе
Массовая доля растворенного вещества – это отношение массы растворенного вещества к общей массе раствора:
m(вещества)
w (вещества) = ——————
m(раствора)
Массовую долю можно выражать и в процентах:
m(вещества)
w (вещества) = —————— · 100%.
m(раствора)
Массовая доля химического элемента в соединении
Массовая для элемента в данном веществе (w) – отношение относительной атомной массы данного элемента, умноженной на число его атомов в молекуле к относительной молекулярной массе вещества.
w(элемента) = (n· Ar(элемента) · 100%) /Mr(вещества) |
где
w – массовая доля элемента в веществе,
n– индекс в химической формуле,
Ar– относительная атомная масса,
Mr– относительная молекулярная масса вещества.
Массовые доли выражают в процентах или в долях:
w(элемента) = 20% или 0,2.
Металлы в природе. Получение металлов
Только мало активные в химическом отношении металлы встречаются в природе в свободном состоянии, поэтому их называют «самородными металлами». Это золото, платина («благородные металлы»), реже Ag, Cu, Hg. Большинство металлов образуют минералы, основой которых являются различные соединения: оксиды, чаще гидратированные (Fe2O3, Fe3O4, Al2O3, SnO2, MnO2); сульфиды и дисульфиды (ZnS, PbS, Ag2S, FeS, FeS2), карбонаты (CaCO3, MgCO3, FeCO3) и другие.
Природные минералы и горные породы, содержащие металлы в таких соединениях и в таких концентрациях, при которых их переработка с целью получения металла экономически целесообразна, называют рудами.
Отрасль промышленности, производящая металлы и их сплавы из природных руд и другого сырья, например, металлического лома, называют металлургией. Различают пирометаллургические (то есть процессы при высоких температурах) игидрометаллургические (процессы в водных растворах) способы получения металлов.
Общие свойства кислот
Кислоты - это сложные вещества, состоящие из одного или нескольких атомов водорода и кислотного остатка. Общая формула кислот НnА, где А - кислотный остаток. Кислоты (с точки зрения электролитической диссоциации) представляют собой электролиты, диссоциирующие в водных растворах на катионы водорода Н+ и анионы кислотного остатка.
Классификация. По наличию (отсутствию) кислорода в составе кислот они подразделяются накислородсодержащие (например, H3PO4 и H2SO4) и бескислородные (например, HCl и HBr). По основности (числу ионов H+, образующихся при полной диссоциации, или количеству ступеней диссоциации) кислоты делятся наодноосновные (если образуется один ион H+: HCl![]() H+ + Cl–; одна ступень диссоциации) и многоосновные –двухосновные (если образуются два иона H+: H2SO4
H+ + Cl–; одна ступень диссоциации) и многоосновные –двухосновные (если образуются два иона H+: H2SO4 ![]() 2H+ + SO42–; две ступени диссоциации), трехосновные(если образуются три иона H+: H3PO4
2H+ + SO42–; две ступени диссоциации), трехосновные(если образуются три иона H+: H3PO4 ![]() 3H+ + PO43–; три ступени диссоциации) и т.д.
3H+ + PO43–; три ступени диссоциации) и т.д.
Физические свойства. Кислоты бывают газообразные, жидкие и твердые. Некоторые имеют запах и цвет. Кислоты отличаются различной растворимостью в воде.
Общие свойства оснований
Основания – сложные вещества, состоящие из атома металла и одной или нескольких гидроксильных групп.Общая формула оснований Ме(ОН)n. Основания (с точки зрения теории электролитической диссоциации) – это электролиты, диссоциирующие при растворении в воде с образованием катионов металла и гидроксид-ионов ОН–.
Классификация. По растворимости в воде основания делят на щелочи (растворимые в воде основания) инерастворимые в воде основания. Щелочи образуют щелочные и щелочно-земельные металлы, а также некоторые другие элементы-металлы. По кислотности (числу ионов ОН–, образующихся при полной диссоциации, или количеству ступеней диссоциации) основания подразделяют на однокислотные (при полной диссоциации получается один ион ОН–; одна ступень диссоциации) и многокислотные (при полной диссоциации получается больше одного иона ОН–; более одной ступени диссоциации). Среди многокислотных оснований различают двухкислотные (например, Sn(OH)2), трехкислотные (Fe(OH)3) и четырехкислотные (Th(OH)4). Однокислотным является, например, основание КОН.
Выделяют группу гидроксидов, которые проявляют химическую двойственность. Они взаимодействую как с основаниями, так и с кислотами. Это амфотерные гидроксиды (см. таблицу 1).




